Destilación
La destilación es una operación unitaria, que tiene por objeto la
separación de los componentes de una mezcla líquida mediante la diferencia de
volatilidades relativas existente en el
sistema.
La importancia de la destilación se remota hasta la época del
tratamiento de las bebidas alcohólicas y se ha venido extendiendo a muchas
industrias, siendo un factor esencial para el funcionamiento de algunas. En
otro aspecto, es un auxiliar muy valiso para la investigación actual en el
campo de la química orgánica. La
destilación tiene innumerables aplicaciones y se emplea a escala industrial y
en pequeñas muestras analíticas en el laboratorio. Se usa con fines muy
variados en purificas uno o varios componentes de una mezcla, o los disolventes
de un proceso que luego se recuperan y recirculan al proceso original. Las
aplicaciones industriales más comunes se encuentran en la refinación del
petróleo y sus derivados, en la industria química, la purificación de
alcoholes, ésteres, éteres, cetonas y disolventes en general.
De lo anterior, podemos resumir que la destilación es el proceso de
separación de los componentes de una mezcla liquida por vaporización parcial de
la misma. La concentración de los componentes
volátiles es mayor en el vapor obtenido que en la mezcla inicial, mientras que
en el residuo aumenta la concentración de los compuestos menos volátiles.
La destilación se puede aplicar a líquidos o mezclas que sean no estables en sus puntos de ebullición
considerando las condiciones de temperatura y presión adecuadas a cada caso.
Un líquido o una mezcla de los mismos, es un fluido que reúne átomos o
moléculas de energía variable. Las mezclas pueden ser miscibles, parcialmente o
totalmente inmiscibles.
La destilación depende de parámetros como: El
equilibrio liquido vapor, temperatura, presión, composición, energía.
- El equilibrio entre
el vapor y el líquido de un compuesto está representado por la relación de
moles de vapor y líquido a una temperatura determinada, también puede
estudiarse este equilibrio a partir de sus presiones de vapor.
- La temperatura
influye en las presiones de vapor y en consecuencia de la cantidad de
energía proporcionada al sistema, también influye en la composición del
vapor y el líquido ya que esta depende de las presiones del vapor.
- La presión tiene directa influencia
en los puntos de ebullición de los líquidos orgánicos y por
tanto en la destilación.
- La composición es
una consecuencia de la variación de las presiones de vapor, de la
temperatura que fijan las composiciones en el equilibrio.
- Puntos de
ebullición, son aquellos puntos o temperaturas de compuestos puros a las
que sus presiones de vapor igualan a la presión atmosférica,
produciéndose el fenómeno llamado ebullición.
Algunos tipos de Destilación son:
ü
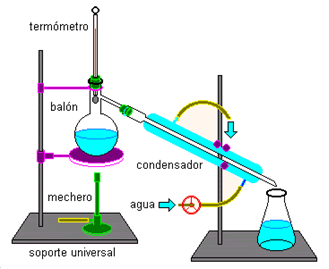
Destilación Simple: es para separar sólidos disueltos en líquidos. Por ejemplo al
querer separar la sal (NaCl) del agua, se calienta la mezcla homogénea: el agua
se evapora y luego se condensa, y en el
recipiente se queda NaCl sólido que no se evapora.
ü
Destilación
Fraccionada: Es
un proceso físico para separar líquidos miscibles en base a la diferencias de
sus puntos de ebullición o condensación. Por ejemplo la mezcla de agua y alcohol (C2H5OH) se
calienta. Primero se evapora con mayor rapidez el de menor temperatura de ebullición (T°ebu Alcohol = 78,5
°C) y luego el de mayor temperatura de
ebullición (T°ebu Agua = 100°C), luego los vapores se condensan en recipientes
separados. Esta operación se lleva a cabo en
columnas de fraccionamiento o de rectificación.
ü Destilación al vacío: Muchas sustancias no pueden purificarse por destilación a la presión
ordinaria, por que se descomponen a temperaturas cercanas a su punto de
ebullición normal, en otros casos la destilación requiere de inmensas
inversiones o utilización de energía en gran cantidad, o finalmente poseen
problemas de equilibrio liquido-vapor, en consecuencia se emplea el método de
destilación al vacío o a presión reducida. Sabemos que un líquido empieza a
hervir cuando su presión de vapor iguala a la presión atmosférica o de
operación, por lo tanto si reducimos la presión de operación tendremos la
ebullición a temperaturas bajas, esta no incluye a la destilación fraccionada.
ü Destilación
en horno de bolas: Consiste en un destilador de vacío sin volúmenes muertos que se utiliza
para la separación entre líquidos o sólidos de bajo punto de fusión y
sustancias poliméricas o aceites de elevado punto de ebullición. En función del
volumen de las bolas escogidas este sistema nos permite destilar desde cantidades pequeñas de producto (50-100 mg) hasta cantidades elevadas de hasta 10-15 g.
ü
Destilación azeotrópica : Técnica usada para romper un azeótropo en la destilación. En uno de los métodos se
adiciona un material agente de separación, otro método, la variación de presión
en la destilación, se basa en el hecho de que un azeótropo depende de la presión y también que no es un rango de
concentraciones que no pueden ser destiladas, sino el punto en el que los
coeficientes de actividad se cruzan. Si el azeótropo se salta, la destilación
puede continuar. Para saltar el azeótropo, el punto de éste puede moverse
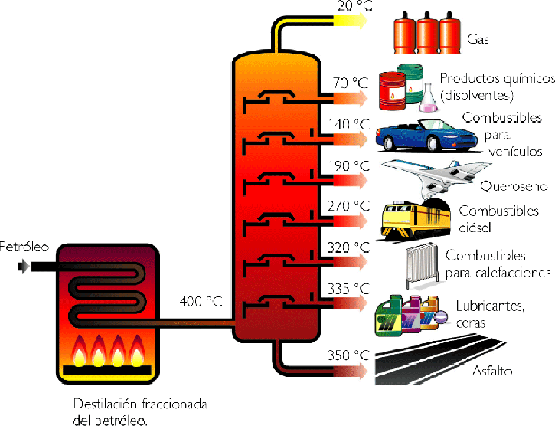
cambiando la presión. Tiene diversas aplicaciones, en la industria del petróleo es
la operación complementaria para la refinación del petróleo, para generar;
gases ligeros, gasolina, queroseno, aceite lubricante, asfalto, etc. Para la
purificación de solventes, en la separación de etanol de los demás productos de
la fermentación de carbohidratos, en la industria de bebidas alcohólicas y
también en la industria petroquímica, etc.



ResponderEliminarEvery Young ladies , Womens & Girl are Found of Shopping .For an Auspicious Occassions Like Festival , Wedding Ceremonies Engagements Ceremony So, Here We Have Some For You In Your Budget. For More....
Plz Visit : - white And Muiti Lehenga
Every Young ladies , Womens & Girl are Found of Shopping .For an Auspicious Occassions Like Festival , Wedding Ceremonies Engagements Ceremony So, Here We Have Some For You In Your Budget.
ResponderEliminarFor More...
embroidery sherwani style suit