Nitración y Dinitración del Benceno
El proceso de nitración es empleado
para grupos nitro en airiáticos y aromáticos, ampliamente utilizados en la
industria como materia prima y de consumo directo. Estos compuestos se
consideran de gran importancia ya que tienen un
amplia aplicación tanto en la industria química como en
la farmacéutica.
Los usos más importantes de los
compuestos nitrados son en la síntesis de alcaloide
anilinas, en las fabricaciones de colorantes, como disolventes en la industria
del petróleo, explosivas, plastificantes y como intermediario
de síntesis de reactivos químicos.
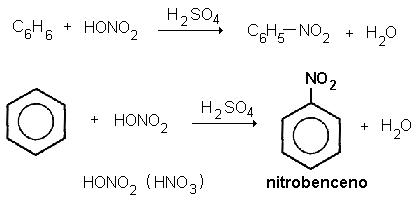
La nitración del benceno no
puede efectuarse sólo con ácido
nítrico, se necesita “activar” el nítrico mediante ácido sulfúrico, más fuerte que él. Se piensa que en ésta reacción
el electrófilo es el ion nitronio, NO2+, que se genera a partir del ácido
nítrico por protonación y pérdida de agua. MECANISMO:
1) Activación del ácido nítrico por el ácido sulfúrico (formación del ion nitronio)
Ion
nitronio
2) Ataque electrófilico sobre el ion nitronio
3) Abstracción del protón por parte de la base conjugada del ácido
sulfúrico.
La
nitración de anillos aromáticos es una reacción de particular
importancia, debido a que los nitroarenos que se producen pueden reducirse con
reactivos como hierro o cloruro estannoso para formar aninoarenos (anilina).
) Sustitución electrofilica aromática del benceno
La reacción más importante de los compuestos aromáticos es la sustitución electrofílica aromática. Esto es, un electrófilo (E+) reacciona con un anillo aromático y sustituye uno de los hidrógenos.
Mediante este tipo de reacción es posible anexar distintos sustituyentes al anillo aromático. Se le puede Halogenar (sustituir con halógeno: -F, -Cl, -I, -Br, -At), Nitrar (sustituir por un grupo nitro: -NO2), Sulfonar (sustituir por un grupo ácido sulfonico -SO3H), Alquilar (sustituir por un grupo alquilo: -R), etc.
Todas estas reacciones pueden ser llevadas a cabo seleccionando los reactivos y condiciones apropiadas.
Nitración Aromática:
Los anillos se pueden nitrar con una mezcla de ácido nítrico y ácido sulfúrico concentrados. Se piensa que el electrofílo es el ion nitronio, NO2+, que se genera del ácido nítrico, por protonacion y perdida de agua. Este ion genera un carbocatión intermediario, cuando este pierde un protón se genera el nitrobenceno como producto de sustitución.
Este proceso es realmente importante para la industria de explosivos, pigmentos y farmacia.
Nitrobenceno
La reacción más importante de los compuestos aromáticos es la sustitución electrofílica aromática. Esto es, un electrófilo (E+) reacciona con un anillo aromático y sustituye uno de los hidrógenos.
Mediante este tipo de reacción es posible anexar distintos sustituyentes al anillo aromático. Se le puede Halogenar (sustituir con halógeno: -F, -Cl, -I, -Br, -At), Nitrar (sustituir por un grupo nitro: -NO2), Sulfonar (sustituir por un grupo ácido sulfonico -SO3H), Alquilar (sustituir por un grupo alquilo: -R), etc.
Todas estas reacciones pueden ser llevadas a cabo seleccionando los reactivos y condiciones apropiadas.
Nitración Aromática:
Los anillos se pueden nitrar con una mezcla de ácido nítrico y ácido sulfúrico concentrados. Se piensa que el electrofílo es el ion nitronio, NO2+, que se genera del ácido nítrico, por protonacion y perdida de agua. Este ion genera un carbocatión intermediario, cuando este pierde un protón se genera el nitrobenceno como producto de sustitución.
Este proceso es realmente importante para la industria de explosivos, pigmentos y farmacia.
Nitrobenceno
2. Electrófilos orientadores orto, meta, para.
En un benceno sustituido con un grupo dador de electrones, ya sea por efecto inductivo o resonante, una reacción de sustitución electrófila dará lugar principalmente a una mezcla de productos orto y para, siendo el producto meta minoritario.
Los grupos dadores por inducción orientan a orto y para. Las formas señaladas con un * son particularmente estables.
- Grupos dadores por inducción:
Analizando
el intermedio de reacción para los distintos ataques, (figura de la derecha),
en el caso de las posiciones orto o para existe una forma resonante
especialmente estable donde la carga positiva está situada adyacente al
sustituyentedador de electrones, y por tanto resulta estabilizada.
Así pues el ataque orto o para conduce a un intermedio más estable que el ataque en meta. La energía de activación de la primera etapa, la determinante de la velocidad, será menor en aquéllos y por tanto serán los productos que se formarán mayoritariamente dando una mezcla de los mismos.
Los grupos dadores por resonancia orientan a orto y para.
- Grupos dadores por resonancia:
Al construir las formas resonantes para los distintos intermedios, (figura de la izquierda), la sustitución en orto y para está favorecida, ya que es posible formular una forma resonante más que para el ataque electrófilo en meta.
Por tanto el intermedio de reacción es más estable cuando el sustituyente entra por la posición orto o para. Esto baja la energía del estado de transición de la primera etapa, que es la que controla la velocidad de la reacción. Así pues está favorecida una mezcla de productos orto y para, mientras que el producto meta será minoritario.
- Halobencenos:
A pesar que los halógenos son desactivantes débiles orientan a orto y para. Esto es debido a los pares de electrones no enlazantes que poseen que pueden deslocalizarse por resonancia. Por tanto en los halobencenos el efecto inductivo domina en la reactividad y en cambio el efecto de la resonancia es el que predomina en la orientación, la regioselectividad, de la sustitución electrófila.
Globalmente, si un grupo que dirige a orto o para es muy voluminoso, (impedimento estérico), el compuesto que se forme será mayoritariamente el para, ya que las posiciones orto estarán más impedidas (menos accesibles). En cambio si es poco voluminoso, el compuesto orto será estadísticamente favorecido, (2 posiciones orto por una para).
Grupos que dirigen a meta
Tanto los grupos aceptores por inducción como por resonancia orientan a meta. Esto es así porque al construir las formas resonantes del intermedio para los distintos ataques, (orto, meta o para), el ataque en meta evita que la carga positiva se sitúe en el carbono unido al grupo atrayente de electrones, que es una situación desfavorable.
Los grupos aceptores orientan a meta. Las formas señaladas con un * son particularmente inestables.
Así pues con sustituyentes desactivantes el ataque se produce preferentemente en meta ya que es el intermedio menos inestable, aunque la reacción sea desfavorable debido a que el anillo aromático está empobrecido electrónicamente, (la sustitución será más lenta que en el benceno).
3. Propiedades físicas y químicas del nitrobenceno y dinitrobenceno
Así pues el ataque orto o para conduce a un intermedio más estable que el ataque en meta. La energía de activación de la primera etapa, la determinante de la velocidad, será menor en aquéllos y por tanto serán los productos que se formarán mayoritariamente dando una mezcla de los mismos.
Los grupos dadores por resonancia orientan a orto y para.
- Grupos dadores por resonancia:
Al construir las formas resonantes para los distintos intermedios, (figura de la izquierda), la sustitución en orto y para está favorecida, ya que es posible formular una forma resonante más que para el ataque electrófilo en meta.
Por tanto el intermedio de reacción es más estable cuando el sustituyente entra por la posición orto o para. Esto baja la energía del estado de transición de la primera etapa, que es la que controla la velocidad de la reacción. Así pues está favorecida una mezcla de productos orto y para, mientras que el producto meta será minoritario.
- Halobencenos:
A pesar que los halógenos son desactivantes débiles orientan a orto y para. Esto es debido a los pares de electrones no enlazantes que poseen que pueden deslocalizarse por resonancia. Por tanto en los halobencenos el efecto inductivo domina en la reactividad y en cambio el efecto de la resonancia es el que predomina en la orientación, la regioselectividad, de la sustitución electrófila.
Globalmente, si un grupo que dirige a orto o para es muy voluminoso, (impedimento estérico), el compuesto que se forme será mayoritariamente el para, ya que las posiciones orto estarán más impedidas (menos accesibles). En cambio si es poco voluminoso, el compuesto orto será estadísticamente favorecido, (2 posiciones orto por una para).
Grupos que dirigen a meta
Tanto los grupos aceptores por inducción como por resonancia orientan a meta. Esto es así porque al construir las formas resonantes del intermedio para los distintos ataques, (orto, meta o para), el ataque en meta evita que la carga positiva se sitúe en el carbono unido al grupo atrayente de electrones, que es una situación desfavorable.
Los grupos aceptores orientan a meta. Las formas señaladas con un * son particularmente inestables.
Así pues con sustituyentes desactivantes el ataque se produce preferentemente en meta ya que es el intermedio menos inestable, aunque la reacción sea desfavorable debido a que el anillo aromático está empobrecido electrónicamente, (la sustitución será más lenta que en el benceno).
3. Propiedades físicas y químicas del nitrobenceno y dinitrobenceno
PROPIEDADES FISICAS Y QUIMICAS DEL NITROBENCENO
* Fórmula: PhNO2 = C6H5NO2
* Masa molecular: 123,11 g/mol
* Punto de fusión: 5,7 °C
* Punto de ebullición: 210,85 °C
* Densidad: 1,19867 g/ml
* Punto de inflamación: 88 °C
* Densidad óptica: nD20 1,5513 - 1,5533
* Nº CAS: 98-95-3
* Solubilidad en agua: 1,9 g/l (20 °C); 2,1 g/l (25 °C)
* Umbral de percepción olfativa: 9,7 - 18,2 ppm
* Concentración máxima permitida en los lugares de trabajo: 1 ppm
PROPIEDADES FISICAS Y QUIMICAS DEL DINITROBENCENO
* Punto de ebullición: 300-303°C
* Punto de fusión: 90°C
* Densidad relativa (agua = 1): 1.6
* Solubilidad en agua: escasa
* Presión de vapor, kPa a 20°C.<0.1
* Densidad relativa de vapor (aire = 1): 5.8
* Punto de inflamación: 149°C
* Coeficiente de reparto octanol/agua como log Pow: 1.49
* Fórmula: PhNO2 = C6H5NO2
* Masa molecular: 123,11 g/mol
* Punto de fusión: 5,7 °C
* Punto de ebullición: 210,85 °C
* Densidad: 1,19867 g/ml
* Punto de inflamación: 88 °C
* Densidad óptica: nD20 1,5513 - 1,5533
* Nº CAS: 98-95-3
* Solubilidad en agua: 1,9 g/l (20 °C); 2,1 g/l (25 °C)
* Umbral de percepción olfativa: 9,7 - 18,2 ppm
* Concentración máxima permitida en los lugares de trabajo: 1 ppm
PROPIEDADES FISICAS Y QUIMICAS DEL DINITROBENCENO
* Punto de ebullición: 300-303°C
* Punto de fusión: 90°C
* Densidad relativa (agua = 1): 1.6
* Solubilidad en agua: escasa
* Presión de vapor, kPa a 20°C.<0.1
* Densidad relativa de vapor (aire = 1): 5.8
* Punto de inflamación: 149°C
* Coeficiente de reparto octanol/agua como log Pow: 1.49
4. Técnicas de
purificación del nitrobenceno y dinitrobenceno.
En la destilación por arrastre con vapor de agua intervienen dos líquidos: el agua y la sustancia que se destila. Estos líquidos no suelen ser miscibles en todas las proporciones. En el caso límite, es decir, si los dos líquidos son totalmente insolubles el uno en el otro, la tensión de vapor de cada uno de ellos no estaría afectada por la presencia del otro. A la temperatura de ebullición de una mezcla de esta clase la suma de las tensiones de vapor de los dos compuestos debe ser igual a la altura barométrica (o sea a la presión atmosférica), puesto que suponemos que la mezcla está hirviendo. El punto de ebullición de esta mezcla será, pues, inferior al del compuesto de punto de ebullición más bajo, y bajo la misma presión, puesto que la presión parcial es forzosamente inferior a la presión total, que es igual a la altura barométrica. Se logra, pues, el mismo efecto que la destilación a presión reducida.
El que una sustancia determinada destile o se arrastre más on menos de prisa en una corriente de vapor de agua, depende de la relación entre la tensión parcial y de la densidad de su vapor y las mismas constantes físicas del agua. Si denominamos P1 y P2 las presiones de vapor de la sustancia y del agua a la temperatura que hierve su mezcla, y D1 y D2 sus densidades de vapor, los pesos de sustancia y de agua que destilan estarán en la relación.
En la destilación por arrastre con vapor de agua intervienen dos líquidos: el agua y la sustancia que se destila. Estos líquidos no suelen ser miscibles en todas las proporciones. En el caso límite, es decir, si los dos líquidos son totalmente insolubles el uno en el otro, la tensión de vapor de cada uno de ellos no estaría afectada por la presencia del otro. A la temperatura de ebullición de una mezcla de esta clase la suma de las tensiones de vapor de los dos compuestos debe ser igual a la altura barométrica (o sea a la presión atmosférica), puesto que suponemos que la mezcla está hirviendo. El punto de ebullición de esta mezcla será, pues, inferior al del compuesto de punto de ebullición más bajo, y bajo la misma presión, puesto que la presión parcial es forzosamente inferior a la presión total, que es igual a la altura barométrica. Se logra, pues, el mismo efecto que la destilación a presión reducida.
El que una sustancia determinada destile o se arrastre más on menos de prisa en una corriente de vapor de agua, depende de la relación entre la tensión parcial y de la densidad de su vapor y las mismas constantes físicas del agua. Si denominamos P1 y P2 las presiones de vapor de la sustancia y del agua a la temperatura que hierve su mezcla, y D1 y D2 sus densidades de vapor, los pesos de sustancia y de agua que destilan estarán en la relación.
Aplicaciones del Nitrobenceno
Aproximadamente el 95%
del nitrobenceno se utiliza para la producción de anilina,3 la
cual es precursora del caucho sintético y en la elaboración de pesticidas , colorantes, explosivos y productos farmacéuticos.
Aplicaciones
especializadas
El nitrobenceno es un
compuesto de partida importante en la síntesis de diversos productos orgánicos,
y aparte de la anilina, para sintetizar labenzidina, el trinitrobenceno,
el ácido nitrobenzolsulfónico,
la fucsina,
la quinolina o fármacos como
el acetoaminofeno.
A veces se utiliza
también como disolvente, por ejemplo de pinturas y otros materiales para
enmascarar olores no placenteros, como componente de lubricantes o como aditivo
en explosivos. También en pulidores de zapatos y pisos, vendajes de piel,
Antiguamente se
utilizaba también redestilado con el nombre de "Aceite de mirbana"1 en
formulaciones de perfumes baratos para jabones. Hoy estas aplicaciones
están prohibidas debido a la elevada toxicidad y
el peligro que supone para el medio
ambiente.
Un significativo mercado
comercial para el nitrobenceno es su uso en la producción del analgésico paracetamol (también
conocido como acetaminofén) (Mannsville 1991).7 El
nitrobenceno es usado también en celdas de Kerr, debido a que tiene una inusualmente
grande constante de Kerr.
Mencione los usos más importantes del
dinitrobenceno:
Los usos más importantes de los compuestos nitrados son en la síntesis de alcaloides, anilinas, en la fabricación de colorantes, como disolventes en la industria del petróleo, explosivas, plastificantes, plásticas y como intermediarios de síntesis de reactivos químicos.


.gif)



No hay comentarios:
Publicar un comentario